[GRADEによる補償フィルター設計製作]
| 科学技術庁 放射線医学総合研究所 重粒子治療センター 治療システム開発室 医用重粒子物理・工学研究部 第三研究室 工学博士 宮原 信幸 様 |


治療システム開発室長
医学博士 遠藤 真広 様

治療システム開発室
医用重粒子物理・工学研究部
第三研究室 工学博士
宮原 信幸 様
はじめに
医療に産業機器あるいは同様な技術が用いられることは珍しくない。リハビリテーションでの義肢、装具、車椅子の設計等は当然として、形成外科等で人工骨を加工して顔面形成を行ったり、人工関節を移植する前の術前検討にCADが用いられることなどは良く知られている。近年では放射線治療においてもCADに準ずる治療計画の利用が活発になっている。ここでは放射線医学総合研究所で行われている重粒子線がん治療でのGRADE/CUBE-NC利用例を述べる。
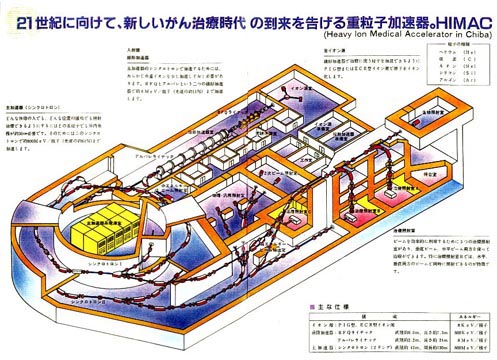
医用重粒子線加速器HIMACと重粒子線の特徴
放射線医学総合研究所では、シンクロトロンと呼ばれる加速器で加速したイオンを用いた粒子線がん治療臨床試行研究が行われている。このシンクロトロンの愛称はHIMAC(Heavy Ion Medical Accelerator in Chiba)と呼ばれている。本装置は長さ約120m、幅65m、最大高さ35mの巨大な装置である。放射線遮蔽に有利なことから大半の構造は地下に埋設されており、最も深い部分は地下20mの深さにある。(図1)
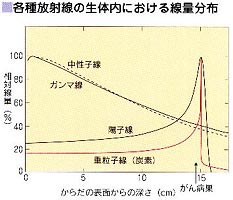
光子線と粒子線の深部線量分布例体内線量分布の比較
重粒子線はその線量分布に特徴があり、X線を光にたとえると重粒子線は射程距離のある銃弾のような振る舞いをする。光の場合、薄いガラス板を並べてこれを透過させるとガラス板の数が増えるに従い徐々に光の強度が低く(暗く)なる。しかしながらガラスがかなり厚くなっても微弱ではあるが光は依然として透過している。重粒子線の場合には、初速に近い部分はガラス板に小さな穴を開けるのみでガラス板にほとんど影響を与えないが、徐々に速度を失うに従い最後にはガラス板を粉々に破壊して停止する。このガラスが破壊される領域を図2におけるピークと置き換えることができる。粒子線飛程終端の鋭いピークをブラッグピークと呼ぶ。
ガンマ線等を放射線がん治療に用いる場合には常に皮膚線量が最大となり、深部に線量を付与することが難しく、また腫瘍を超えた領域にも線量を与える危険があるが、粒子線の場合にはエネルギー(速度)によって得られる射程距離(飛程)がはっきり決まっており、入射部では比較的低い線量を付与し飛程終端での線量付与が最も大きい。(図3)
重粒子線の照射システム
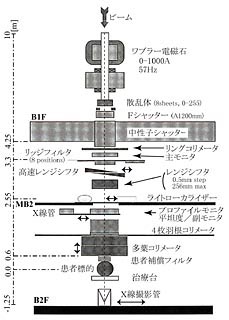
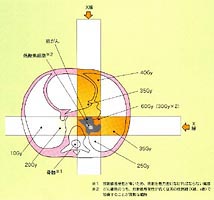
重粒子線の特徴として患者体内深部に高線量を形成できることをこれまでに述べた。しかしながら、この高線量域の体積は極めて小さいので腫瘍の三次元形状をカバーするように引き延ばす必要がある。HIMACにおける照射野形成の概略を図4に示す。
加速器から散乱体ならびに一対のワブラーマグネットを用いて平坦な照射野を形成する。次にブラッグピークの幅は極めて狭いので、これを腫瘍の厚みまで引き延ばす必要がある。HIMACではバーリッジフィルターを用いてブラッグピークを引き延ばしている。このリッジフィルターの原理は、バーリッジの隙間を通ったビームは最深部まで到達するがバーリッジを通過したビームは最終到達点が浅くなる。リッジフィルターを通ったビーム全体をたし合わせると所定の引き延ばされたビームとなる。
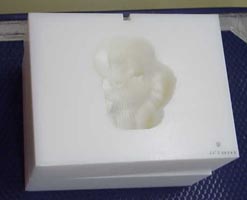
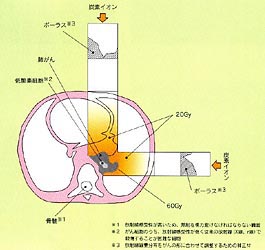
入射面から飛程終端までが一定距離である腫瘍に対しては、あるエネルギーの粒子線を照射することで治療が行えるが、現実には体輪郭ならびに腫瘍形状は複雑な形をしており、臓器ごとに密度が異なるので飛程の調整を行う必要があり、補償フィルターを用いる。この補償フィルターは腫瘍の雌型のようなものと言える。すなわち補償フィルターの最も浅いところを通った場合には最深部までビームが到達し、補償フィルターの厚みが増すにつれビームは浅い方向にシフトする。腫瘍形状ならびに患者体内の密度の分布は複雑であるので補償フィルターは自ずと複雑な形状となる。補償フィルター形状の設計ならびに製作について以下に述べる。
治療計画

はじめに患者体内の腫瘍形状ならびに体内密度分布を知る必要があるのでX線CT撮影を行う。
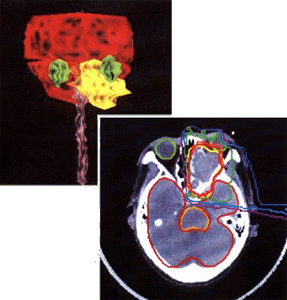
CTスライス画像上で患者の臓器ならびに腫瘍輪郭を抽出し三次元の臓器形状をモデリング(図7)する。
モデリングされた画像上で放射線感受性の強い臓器への線量投与のない照射方向を選ぶ。腫瘍の最も深い部位までビームが到達するエネルギーを選択するのであるが、このとき体表面から腫瘍最深部までの密度情報がなければならない。この密度情報はX線の透過率をCTナンバーと呼ばれる指数で表すことができるので、これから患者体内での水相当の密度分布を知ることができる。当然のことながら照射方向から見て最も深い部位まで到達することのできるビームエネルギーを選択することになるが、ビームの飛程終端が腫瘍最深部にそろってしまう。そこで正常組織の線量を低減するために飛程の行き過ぎた長さの分布を求めることにより補償フィルターの形状が決定される。すなわち行き過ぎた飛程分の吸収体の分布を与えることにより腫瘍辺縁に限局された飛程終端分布を得ることができる。(図8)
治療計画はCT画像をもとにしているので画素に起因するピッチでデータが作成される。このため補償フィルターの飛程吸収分布は3mmピッチで出力される。吸収体の厚さそのものは水等価厚に換算されるため実数で出力される。
補償フィルター作成
補償フィルターの材料としては高エネルギービーム照射による長寿命核種が発生しないこと、放射減衰が早く技師ならびに医師の被爆が少ないこと、落下等によって破壊する心配のないこと、品質が安定していること、ならびに比較的安価であることから高密度ポリエチレンを使用している。また、この材料は電子密度がほぼ水と等価であり、治療計画で出力される補償フィルターデータそのものを加工データとして利用できる。
補償フィルターの作成に先立つ治療計画では3mmピッチの点群データが出力されるのみであるので、これを三次元の面データに変換する必要がある。当初はパソコンベースのホームメイドソフトウエアを使用して点群をワイヤーフレームでレンダリングして二次元の加工データをスタックして3次元の加工を行っていたが、カッターパスに自由度がなく極めて長時間の加工時間を要していた。また走査切削しかできないためエンドミルの破損や、エンドミルの逃げによる精度の悪化も問題であった。
1997年にGRADE/CUBE-NC(図9)を導入するに当たり、点群データを面データに変換するアプリケーションも同時に発注した。面群生成ならびにカッターパス生成に要する時間はパソコンベースで作業していた場合とそれほど変わらないが、加工時間そのものはほぼ半減した。加工精度については最適なカッターパス選択が可能になったこともあり、従来最大±1mmほどあった公差を±0.1mm程度に向上することが可能となった。複雑形状の樹脂切削加工としては極めて高い工作精度と言って良いであろう。


また、GRADE/CUBE-NC導入にあわせてパレットチェンジャーを付設するマシニングセンター(図10)を導入し、夜間の無人運転を開始したことにより一日あたりの処理能力は従来の約4倍となった。これらの性能の向上により従来治療計画終了して3~4日後に治療開始可能であったが、現在では治療計画終了後2日後に治療開始が可能になっており、治療患者の増加に十分対応できている。
重粒子線がん治療臨床試行の状況について
◆ 臨床試行の現状及びその評価
平成11年10月までの患者総数は約700名である。このうち平成10年8月までの約4年間に臨床試行に参加され、半年以上経過観察が可能な473名について、評価部会(平成11.3.11開催)で治療成績の評価が行われ、その結果がネットワーク会議(平成11.3.19開催)に報告された。
照射後の副作用(有害反応)についてみると、皮膚、粘膜、あるいは肺などで強度の急性期反応を呈する例があったが、長期的にはいずれも問題なく回復していた。しかし、一部に段階的線量増加に伴う消化管の潰瘍または穿孔がみられ手術を要する例もあった。これらの症例については詳細に検討して、適正線量を決定するとともに照射方法を改善するなどした結果、これ以降の治療では重篤な副作用を認めなくなった。
各部位の局所制御率は頭頚部で80%、肺59%、肝78%、前立腺100%、子宮70%、骨軟部57%である。以上の結果は、比較的進行がんが多く、当初低い線量で照射された患者のいたことも考えると、良好な結果との評価を受けている。脳腫瘍に対してはまだ線量増加中であり、生存率の向上が認められるようになった。
